
Estudos em andamento
Quer participar?
Estudo em aberto:
Avaliação de Quimiorresistência de Tumores
in vitro. - Plataforma Brasil: 22870019.2.0000.5327
Médico e paciente precisam fazer o cadastro completo.

Estudo em aberto:
Avaliação de Quimiorresistência de Tumores
in vitro. - Plataforma Brasil: 22870019.2.0000.5327
Médico e paciente precisam fazer o cadastro completo.
*as fichas clínicas devem ser preenchidas pelo médico no momento da solicitação de sua avaliação e durante o acompanhamento/seguimento
**A Oncologia de Precisão disponibiliza o contato de empresas parceiras, entretanto, ao aceitar participar do estudo fica implícito que o custo, rastreio e responsabilidade de transporte é do paciente/responsável legal do paciente.
Critérios de Inclusão:
Pacientes diagnosticados com neoplasias de mama ou ovário com indicação de terapia sistêmica como parte de seu tratamento.
Critérios de exclusão:
Serão excluídos do estudo pacientes gestantes e pacientes que não tiverem diagnóstico confirmado para as neoplasias descritas acima.
É necessário preenchimento do CADASTRO MÉDICO ou do CADASTRO PACIENTE, agendar a coleta e preencher todas as informações solicitadas na ficha clínica.
A coleta e envio do material biológico deverá ser realizada após confirmação do agendamento pela Oncologia de Precisão. ENTENDA A COLETA - CLIQUE AQUI
É necessário material fresco oriundo de biópsia ou cirurgia coletado em meio de transporte específico fornecido pela ONCOLOGIA DE PRECISÃO.
Para realização do teste é necessário agendamento prévio para recebimento de todas as informações. Não serão aceitas amostras sem notificação prévia.
O estudo permanece aberto até janeiro de 2021 e durante este período os testes serão gratuitos.
O câncer de mama é o tumor mais prevalente e principal causa de morte por neoplasia em mulheres (Ferlay et al., 2013). Segundo o GLOBOCAN, estimaram-se cerca de 2 milhões de novos casos no mundo em 2018. Atualmente, é o câncer mais comum em regiões desenvolvidas e em desenvolvimento. No Brasil, em 2020 estimam-se mais de 66 mil casos novos de câncer de mama, ou seja, 61 novos casos a cada 100 mil mulheres (INCA 2020).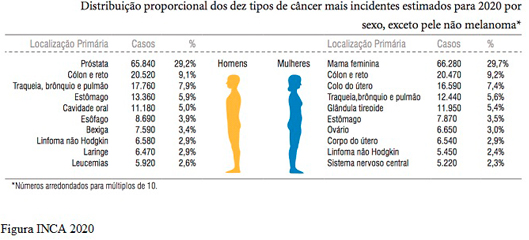
O câncer de mama pode ser classificado de acordo com seu tipo histológico, grau histológico, e estadiamento através do sistema TNM (T: tamanho do tumor; N: número de linfonodos acometidos; M: metástase à distância) (Giuliano et al., 2017). Ainda, a neoplasia mamária pode ser classificada de acordo com seu perfil de expressão gênica em 5 diferentes subtipos: Luminal A, Luminal B, HER2, Basal e Normal (Tabela) (Perou et al., 2000; Cancer Genome Atlas Network 2012). Em 2009, com o surgimento do teste com micro-arranjos de DNA denominado PAM50, baseado na expressão gênica de 50 genes, os 5 subtipos conhecidos de câncer de mama foram divididos em 4 subtipos: Luminal A, Luminal B, HER2 e Basal (Parker et al., 2009; Prat et al., 2015).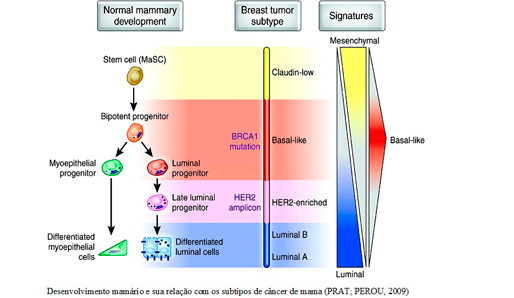
Os subtipos luminais representam a maioria dos cânceres de mama. O subtipo Luminal A apresenta positividade para receptores de estrogênio (RE), e receptores de progesterona (RP), negatividade para HER2 e baixa expressão de KI67 (Goldhirsch et al., 2013). Estes compreendem aproximadamente 40% de todos os cânceres de mama e possuem um bom prognóstico devido à possibilidade do uso de terapia hormonal (Cancer Genome Atlas Network 2012; Engebraaten et al., 2013).
O subtipo luminal B se distingue do Luminal A por ter menor expressão de RE, não expressar ou apresentar maior expressão de KI67 e podendo ser positivo para HER2 (Goldhirsch et al., 2013). Este pode ser tratado com combinações de tratamentos dependendo da expressão dos marcadores. Tumores RE e KI67 positivos, e HER2 negativos normalmente são tratados com combinação de terapia endócrina e quimioterapia, e tumores RE e HER2 positivos, e KI67 negativos são tratados com quimioterapia, terapia hormonal, e terapia anti-HER2 (Toss et al., 2015).
Sendo aproximadamente 15% dos tumores de mama, o subtipo HER2 apresenta quantidade variável de receptores hormonais, geralmente sendo RE e RP negativos, mas possuindo superexpressão do protooncogene HER2 (Toss et al., 2015). Pacientes HER2 positivas vem apresentando uma grande melhora no prognóstico com o uso do anticorpo monoclonal anti-HER2, esta terapia alvo age no gene HER2 inibindo o crescimento das células neoplásicas (Cancer Genome Atlas Network 2012; Engebraaten et al., 2013).
O câncer de mama basal representa aproximadamente 15% dos casos de câncer de mama e possuí a tendência de afetar pacientes jovens. É reconhecido por apresentar um padrão de expressão gênica bastante semelhante das células epiteliais basais do tecido mamário saudável apresentando alta expressão de queratinas 5 e 17, e laminina (Toss et al., 2015; Engebraaten et al., 2013). Contudo, estes tumores apresentam características semelhantes às células tronco tumorais ou células progenitoras (Ricardo et al., 2011; De Beça et al., 2013). Devido sua negatividade para os receptores hormonais (RE, RP) e baixa ou nenhuma expressão de HER2, esta neoplasia muitas vezes é classificada como triplo negativa. Os tumores triplo-negativos normalmente acometem mulheres jovens que se encontram na pré-menopausa, e que apresentam mutação no gene BRCA1 e 2 (Lindner et al., 2013; Engebraaten et al., 2013; Kroenke et al., 2014). Tumores triplo-negativos geralmente apresentam características do subtipo basal e tumores basais normalmente são classificados como triplo-negativos (Cidado et al., 2013). Pela ausência de marcadores específicos para este subtipo de câncer de mama, o tratamento consiste em quimioterapia.
O subtipo normal possui padrão de expressão gênica similar as células epiteliais normais, tecido adiposo e outras células não-epiteliais, mas não apresentam genes associados com proliferação (Sorlie et al., 2001).
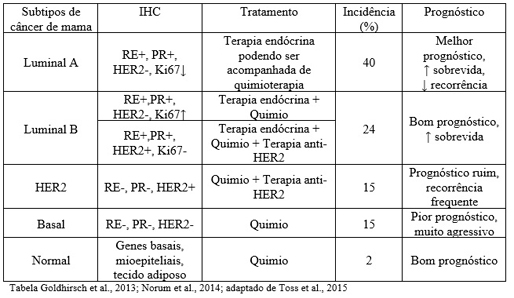
Os diferentes subtipos moleculares de câncer de mama possuem diferentes fatores de risco, incidências, prognósticos, e sensibilidade aos diferentes tratamentos (Phipps et al., 2011(a); Phipps et al., 2011(b); Ritte et al., 2012). Existem muitas combinações de medicamentos estabelecidas nos protocolos clínicos de acordo com o subtipo do câncer, porém, progressão e metástases ainda são problemas recorrentes desta neoplasia, e por isso, a avaliação personalizada e de precisão para guiar a escolha da terapia mais adequada e menos tóxica torna-se fundamental.
Cada paciente possui um perfil de resposta a drogas diferente, baseado na sua diversidade genética e fenotípica. Através de testes que identifiquem diferenças individuais na resposta tumoral às drogas é possível desenvolver regimes específicos dirigidos às características de cada paciente reduzindo efeitos adversos e custos associados aos tratamentos, e aumentando resposta (Haroun, 2002).
Os testes de quimiorresistência destinam-se a identificar drogas às quais o tumor é resistente, enquanto testes de quimiossensibilidade objetivam identificar drogas às quais o tumor é mais sensível. Ambos os ensaios são realizados para avaliar se o crescimento do tumor é inibido por um medicamento ou, mais comumente, por um painel de drogas combinadas.
Diversos estudos têm demonstrado resultados promissores com testes de avaliação de resposta a drogas. Mehta e colaboradores (2001) avaliaram tumores de mama quanto à resistência convencional com antraciclina e ciclofosfamida ou ciclofosfamida, metotrexato e 5-fluoracil. Os autores observaram que o tempo médio de progressão foi significativamente menor para pacientes com resistência extrema ou intermediária in vitro (n = 55, 48 meses) comparados a pacientes com baixa resistência in vitro (n = 41, 100 meses, p = 0,022). Pacientes demonstrando resistência extrema ou intermediária às drogas tiveram pior sobrevida do que o grupo de baixa resistência (p = 0,011). Em uma revisão da literatura, Volm & Efferth (2015) demonstraram que a predição de resistência e sensibilidade causam impacto significativo em sobrevida de diferentes tipos de tumores como gliomas, leucemias, câncer de mama e pulmão. E ainda, uma recente metanálise sugere que quando existem regimes de tratamentos considerados igualmente eficazes, testes de resistência e sensibilidade são capazes de predizer resposta individualizada (Blom et al., 2017).
A empresa Ziel Biosciences desenvolveu e patenteou o primeiro teste de quimiorresistência in vitro, ChemoBiogram, buscando solucionar estes problemas (INPI BR 10 2013 019219-8: Kit, seu processo de obtenção, e processo in vitro para avaliação de viabilidade e/ou proliferação celular em relação a um ativo e PCT/BR2015/050008: Kit, seu processo de obtenção, e processo in vitro para avaliação de viabilidade e/ou proliferação celular em relação a um ativo, e BR 102020001470-6).
O ChemoBiogram foi desenvolvido no Brasil e compreende uma placa de 96 poços contendo os principais quimioterápicos e drogas-alvo utilizados na clínica médica para o tratamento de neoplasias. Os quimioterápicos são previamente inseridos na plataforma na dosagem correta para um determinado número de células tumorais que devem ser inseridas em cada poço. Para a realização do teste, necessita-se de tecido tumoral fresco, obtido através de procedimento realizado pelo médico e equipe assistente em biópsia ou cirurgia.
Blom K, et al. Predictive Value of Ex Vivo Chemosensitivity Assays for Individualized Cancer Chemotherapy: A Meta-Analysis. SLAS Technol. Jun;22(3):306-314, 2017
Cancer Genome Atlas Network. Comprehensive molecular portraits of human breast umours. Nature 490: 61-70, 2012
De Beça FF, et al. Cancer stem cell markers CD44, CD24 and ALDH1 in breast cancer special histological types. J Clin Pathol. 66(3):187-191, 2013
Cidado J, et al. Needles in a haystack: finding recurrent genomic changes in breast cancer. Breast Can Res. 14(1):304, 2013
Engebraaten O, et al. Triple-negative breast cancer and the need for new therapeutic targets. Am J Pathol. 183(4):1064-1074, 2013
Ferlay YJ, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Can. 1;136(5):E359-86, 2012
Giuliano AE, et al. Breast Cancer-Major changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA A Cancer Journal for Clinicians 8;67(4):290-303, 2017
Goldhirsch A, et al. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Ann Oncol. 24:2206-2223, 2013
Haroun RI, et al. Extreme drug resistance in primary brain tumors: in vitro analysis of 64 resection specimens. J Neurooncol. 58:115-23, 2002
INCA: http://www.inca.gov.br.
Kroenke CH, et al. Race and breast cancer survival by intrinsic subtype based on PAM50 gene expression. Breast Can Res Treat. 144(3):689-699, 2014
Lindner R, et al. Molecular phenotypes in triple negative breast cancer from African American patients suggest targets for therapy. PLoS One 8(11):71915, 2013
Mehta RS, et al. Breast cancer survival and in vitro tumor response in the extreme drug resistance assay. Breast Can Res Treat. 66:225–237, 2001
Norum JH, et al. Lessons learned from the intrinsic subtypes of breast cancer in the quest for precision therapy. Br J Surg. 101(8):925-938, 2014
Parker JS, et al. Supervised Risk Predictor of Breast Cancer Based on Intrinsic Subtypes. J Clin Oncol. 27(8):1160-1167, 2009
Perou C M, et al. Molecular portraits of human breast tumours. Nature 406:747-52, 2000
Phipps AI, et al. Reproductive history and oral contraceptive use in relation to risk of triple-negative breast cancer. J Nat Cancer Inst. 103(6):470-477, 2011
Phipps AI, et al. Body size, physical activity, and risk of triple-negative and estrogen-receptor-positive breast cancer. Cancer epidemiology, biomarkers and Prevention 20(3):454-463, 2011
Prat A, et al. Clinical implications of the intrinsic molecular subtypes of breast cancer. Breast 24 Suppl 2:S26-35, 2015
Ricardo S, et al. Breast cancer stem cell markers CD44, CD24 and ALDH1: expression distribution within intrinsic molecular subtype. J Clin Pathol. 64(11):937-946, 2011
Sorlie T, et al. Gene dullexpression pattern of breast carcinomas distinguish tumor subclasses with clinical implications. Proceedings of the National Academy of Sciences of the USA 98(19):10869-10874, 2001
Toss A, et al. Molecular characterization and targeted therapeutic approaches in breast cancer. Breast Cancer Research 17:60, 2015